 Селітра-узагальнене визначення мінеральних азотнокислих солей, що містять нітрати металів першої і другої груп таблиці елементів, а також амонію. Протягом багатьох років робилися спроби обмежити і навіть заборонити застосування селітри, кілька разів її відносили до категорії небезпечних для здоров'я людей. Однак, фахівці переконувалися, що людство поки не знайшло йому гідної альтернативної заміни.
Селітра-узагальнене визначення мінеральних азотнокислих солей, що містять нітрати металів першої і другої груп таблиці елементів, а також амонію. Протягом багатьох років робилися спроби обмежити і навіть заборонити застосування селітри, кілька разів її відносили до категорії небезпечних для здоров'я людей. Однак, фахівці переконувалися, що людство поки не знайшло йому гідної альтернативної заміни.
Загальні властивості речовини
Всі види мають форму кристалів, розчинні у воді. Служать базовими компонентами для створення більше 20 різновидів мінеральних азотних добрив, що застосовуються в сільському господарстві. селітра характеризується наступними властивостями:
- Легкоплавка. При нагріванні змінює структуру і розкладається на нітрити і кисень.
- Притаманні антибактеріологічні, консервуючі та дезінфікуючі властивості.
- Продукти мають подібний зовнішній вигляд. Зазвичай білястого кольору. Добавки додають трохи жовтизни. Візуально важко помітні.
- В нормальному стані не мають запаху. При попаданні невеликої кількості води продукти розкладаються і виділяють специфічні міазми.
Недоліками є висока гігроскопічність і вибухонебезпечність. Вироби потребують особливих умовах для тривалого зберігання.
Вимагає точного дотримання інструкцій із застосування. Навіть незначне перевищення дозувань здатне привести до небезпечних для здоров'я людей наслідків.
Види селітри
Елементи відрізняються великим видовим розмаїттям . Безпосередньо до групи селітри відносяться 7 речовин. Це азотнокислі солі натрію, калію, амонію, барію, стронцію, кальцію, магнію. У повсякденній практиці мають різні найменування.
 Нітрат амонію . Відомий як аміачна і амонійна селітра. Хімічна формула-NH4NO3. Поширений спосіб виробництва-хімічна реакція безводного аміаку (нітрид водню) і концентрованої сірчаної кислоти. NH3 + HNO3 = NH4NO3. Процес носить екзотермічний характер, тобто виділяється велика кількість тепла. Виробництво поза спеціальних промислових зон загрожує травмами. Для отримання необхідної хімічної сполуки з природного фосфату кальцію його перетворюють в нітрат кальцію, відокремлюють фосфор і з'єднують з нітридом водню. На виході виходить шуканий товар.
Нітрат амонію . Відомий як аміачна і амонійна селітра. Хімічна формула-NH4NO3. Поширений спосіб виробництва-хімічна реакція безводного аміаку (нітрид водню) і концентрованої сірчаної кислоти. NH3 + HNO3 = NH4NO3. Процес носить екзотермічний характер, тобто виділяється велика кількість тепла. Виробництво поза спеціальних промислових зон загрожує травмами. Для отримання необхідної хімічної сполуки з природного фосфату кальцію його перетворюють в нітрат кальцію, відокремлюють фосфор і з'єднують з нітридом водню. На виході виходить шуканий товар.
- Калійна селітра . Вживані назви: калієва, Індійська селітра, нітрат калію і азотнокислий калій. Хімічна формула селітри-KNO3. У природі залягає у вигляді мінералу нітрокаліт. За винятком покладів в Ост-Індії, інших великих ресурсів немає. Тому цей вид селітри називають індійської. Нітрат калію не токсичний, гігроскопічність слабка. Практично не злежується. Розкладається при відносно високій температурі (500 0 C). Виділяється нітрит калію (KNO3) і кисень (О2). Існує кілька способів отримання продукту в промислових масштабах. Перспективним вважається виробництво з нітрату магнію (MgNO3) і хлористого калію (KCl). Перевага методу в достатку сировини. Компоненти не відносяться до дефіцитних. Інший спосіб-конверсія нітратів амонію і натрію в калієву селітру.
- Натрієва селітра . Традиційні найменування: нітрат натрію, натронна селітра. Часто вживається поняття чилійська селітра. Формула-NaNO3. Сильно вбирає вологу, що ускладнює зберігання і обмежує застосування в деяких сферах (виготовлення піротехніки). Розкладання починається з T = 380 0 С.утворюються нітрит натрію (NANO2) і кисень. Вільно вступає в хімічні реакції з солями лужних металів, утворюючи нові сполуки. Володіє сильними окислювальними характеристиками. Виготовляється хімічним способом шляхом реакції гідроксиду натрію (їдкого натру, їдкого лугу, каустичної соди) або кислих натрієвих солей з азотною кислотою. Сировинна база широка. Дефіциту компонентів не відчувається. У природних умовах зустрічається на родовищах в Чилі. Але вони сильно виснажені і вже не грають колишньої роді. Проте найменування країни міцно зміцнилося в селітрі.
- Кальцієва селітра . Супутні найменування: нітрат кальцію, Норвезька (за місцем основного видобутку), вапняна селітра, азотнокислий кальцій. Хімічна формула- (СaNO3) 2. Характерна особливість: найсильніша серед аналогів гігроскопічність. Зберігають в сухих місцях без доступу вологи. Не горить. При зіткнеться кисень і Ca (NO2)2. Основний спосіб випуску-вплив азотної кислоти на вапняк (CaCO3). Крім нітрату, цим способом отримують чистий оксид кальцію-негашене вапно, що застосовується в промисловості.
- Нітрат барію . Той же продукт-Барієва, баритовая селітра. Формула Ba (NO3) 2. Головний сировинний ресурс для отримання продукту гірничо — шахтним шляхом-мінерал нітробарит. Хімічний метод пов'язаний із взаємодією сульфіду барію (ВаЅ) або карбонату барію (ВаСО3) з азотною кислотою. Продукт токсичний, горючий, вибухонебезпечний.
- Магнієва селітра . Хімічна формула Mg (NO3) 2. При T = 300 9 C і вище розкладається на оксиди магнію (MgOB) та азоту. Розчинна у воді. Має низьку електропровідність. Схильна до Gorenje. Сприяє поширенню вогню.
- Нітрат стронцію(стронцієва селітра, азотнокислий стронцій). Формула Sr (NO3) 2. Отримують реакцією карбонату стронцію (SrO3) і азотної кислоти. Розчинний у воді. При T = 100 0 з продукт зневоднюється. У нього з'являються властивості вибухової речовини.
Застосування в якості добрив
 Всі види нітратів входять до групи органічних азотнокислих добрив
. Азот відноситься до числа провідних хімічних елементів, що збільшують вегетативну, білкову і клейковидну масу рослин.
Всі види нітратів входять до групи органічних азотнокислих добрив
. Азот відноситься до числа провідних хімічних елементів, що збільшують вегетативну, білкову і клейковидну масу рослин.
У зв'язку з цим удобрення відводиться важлива роль ефективного засобу для підвищення врожайності сільськогосподарських культур.
Найбільш затребуваний товар — нітрат амонію. Застосуємо для всіх культур. Використовується в різні періоди сільськогосподарських робіт. Захищає рослини від грибкових та інших захворювань. Норма застосування-не більше 50 г / м 2 , в садах-10 г / м 2 . Інакше не уникнути опіку кореневищ.
- Калієвий продукт — головне джерело калію, в якому відчувають дефіцит рослини і тварини. Врівноважує мінеральний баланс в тканинах рослин, покращує фотосинтез. Оптимальний для підгодівлі.
- Нітрат кальцію. Важливий для підживлення землі кальцієм, який сприяє підвищенню врожаю. Збільшує термін зберігання плодоовочевих товарів. Запобігає гальмуванню розвитку та загниванню кореневої системи.
- Натрієва селітра. Культивується в передпосівний період. Краща для рядкового застосування. Офіційно зареєстровано тільки одне добриво. Особливість-поглинається тільки біологічно. При відсутності рослин вимивається грунтовими водами, дощами. Придатна для всіх грунтів, крім солончаків. Легко засвоюється рослинами. Ефективна для цукрових буряків (збільшує вихід цукру) і коренеплоди.
- Магнієва селітра. У магнії відчувають потребу бобові культури. Меншою мірою інші овочі. Елемент необхідний для прискорення процесів росту, підтримки рівня білків, засвоєння фосфору.
Використання в якості вибухових речовин
 Азотнокислі речовини є базовими структурними елементами всіх груп вибухових речовин (ВВ).
Азотнокислі речовини є базовими структурними елементами всіх груп вибухових речовин (ВВ).
До метальних ВВ відносяться димні пороху, які виготовляються з суміші калієвої селітри, сірки і деревного вугілля.
Бризантні ВВ слабкіше реагують на зовнішні впливи, ніж інші аналогічні продукти. Однак вони мають більшу потужність. Аміачна селітра з додаванням горючих компонентів (торф, дизельне паливо, вугілля, алюмінієва пудра, деревне борошно) утворює вибухівки амонали і амоніти різної потужності. Використовуються в бойових снарядах, а також в гірничодобувній і дорожньо-будівельній сферах.
Нітрати калію та натрію - головні структурні компоненти динамітів.
Стронцієвий і барієвий продукти застосовуються для виготовлення піротехнічних виробів побутового призначення. З них виготовляють боєприпаси світлової та шумової дії.
Інші сфери застосування
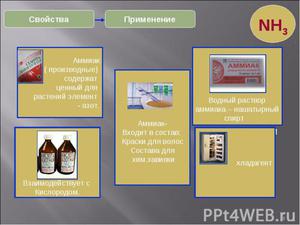 Напрямки використання селітри різноманітні . Це необхідний компонент у виробництві чорного пороху, сірникових і скляних виробів. У харчовій галузі задіють для випуску копченостей, а також зберігання м'ясних і ковбасних виробів, в металургії — для загартування сталей. Гарне протравляющее речовина для текстильної індустрії.
Напрямки використання селітри різноманітні . Це необхідний компонент у виробництві чорного пороху, сірникових і скляних виробів. У харчовій галузі задіють для випуску копченостей, а також зберігання м'ясних і ковбасних виробів, в металургії — для загартування сталей. Гарне протравляющее речовина для текстильної індустрії.
Нафтовики застосовують її при створенні гелеутворюючої облямівки, що служить для підвищення віддачі пласта.
Дослідження вчених відкривають нові можливості для хімічної сполуки. Селітра стає структурним елементом ракетобудування, виробництва автомобілів, морських суден.


